人工驯化野生绶草栽培基质的研究
摘要:绶草是我国濒危二级保护植物,现已列入《濒危野生动植物种国际贸易公约》。但由于种子极小,属于无胚乳类型,自然条件下种子萌发率极低。随着人们对绶草药用价值和观赏价值的认识,绶草的驯化栽培及营养繁殖等人工繁育技术是解决绶草资源保存、重新引入自然界及满足商业需求的最有效方法。本研究以张家口市宣化区常峪口村的野生绶草植株为试验材料,利用不同的栽培基质(处理1:草炭土∶蛭石=3∶1,处理2:草炭土∶园土∶蛭石∶饼肥=2∶2∶1∶1,处理3:100%根原土)进行绶草人工驯化栽培试验,测定不同栽培基质的物理性状以及不同栽培基质的绶草根际真菌分布情况,观测绶草植株移栽后的发育期进程、株高、花茎长度及花量等处理效果。
结果表明,不同栽培基质的密度和容重比较,处理3>处理2>处理1,3个处理的总孔隙度分别为72.1%、65.3%和54.6%,pH值分别为5.9、6.4和7.5;并对3种栽培基质进行真菌分离,处理1分离出5种真菌,处理2分离出6种真菌,处理3的真菌种类最多,共8种;结合不同基质下绶草的株高、花茎长度和花量等生长指标分析,处理3对于植株的生长状况及发育期进程的影响最大、处理效果最佳,处理1次之,处理2效果稍差,虽然3种处理下的植株生长状况有所不同,但在人工驯化过程中,3种基质下的绶草均未出现停长或死亡现象,表明3种栽培基质均可成功用于人工驯化绶草植株。
结果表明,不同栽培基质的密度和容重比较,处理3>处理2>处理1,3个处理的总孔隙度分别为72.1%、65.3%和54.6%,pH值分别为5.9、6.4和7.5;并对3种栽培基质进行真菌分离,处理1分离出5种真菌,处理2分离出6种真菌,处理3的真菌种类最多,共8种;结合不同基质下绶草的株高、花茎长度和花量等生长指标分析,处理3对于植株的生长状况及发育期进程的影响最大、处理效果最佳,处理1次之,处理2效果稍差,虽然3种处理下的植株生长状况有所不同,但在人工驯化过程中,3种基质下的绶草均未出现停长或死亡现象,表明3种栽培基质均可成功用于人工驯化绶草植株。
绶草[Spiranthessinensis.(Pers.)Ames.Orch]又名盘龙参,为兰科绶草属植物,生于海拔200~3400m的山坡林下、灌丛下、草地或河滩沼泽草甸中的珍贵陆生植物,药用价值及观赏价值都极高,是珍贵的小型兰科植物,属于国家濒危二级保护植物,现已列入《濒危野生动植物种国际贸易公约》[1-3]。绶草全株可入药,含有多种药理活性成分,具有抗病毒、抗肿瘤、益气滋阴、润肺止咳等功效[4-8]。绶草花茎直立,长10~25cm,总状花序具多数密生的花,呈螺旋状扭转,花小,紫红色、粉红色或白色,在花序轴上呈螺旋状排生[9],是园林景观地被植物的首选[10]。
通常绶草一枚硕果中的种子数量高达104~106粒,但由于种子极小[11-12],属于无胚乳类型,其在自然条件下种子萌发率极低[13]。此外,自然条件下绶草的童期很长,一般需要5~10a才能开花结实,进一步制约了绶草在全世界的分布和开发利用。随着人们对绶草药用价值和观赏价值的认识,越来越多野生资源被挖掘,但由于其有性繁殖力极低,导致绶草在全世界范围的种类及数量减少,甚至濒临灭绝[14]。因此,绶草的驯化栽培及营养繁殖等人工繁育技术是解决绶草资源保存、重新引入自然界及满足商业需求的最有效方法[4,15-16]。
通常绶草一枚硕果中的种子数量高达104~106粒,但由于种子极小[11-12],属于无胚乳类型,其在自然条件下种子萌发率极低[13]。此外,自然条件下绶草的童期很长,一般需要5~10a才能开花结实,进一步制约了绶草在全世界的分布和开发利用。随着人们对绶草药用价值和观赏价值的认识,越来越多野生资源被挖掘,但由于其有性繁殖力极低,导致绶草在全世界范围的种类及数量减少,甚至濒临灭绝[14]。因此,绶草的驯化栽培及营养繁殖等人工繁育技术是解决绶草资源保存、重新引入自然界及满足商业需求的最有效方法[4,15-16]。
本研究以张家口市宣化区常峪口村的野生绶草为试材,选用不同的栽培基质进行人工驯化栽培,通过对绶草生物学性状的测定,筛选出适宜人工栽培的基质种类及配比,为绶草种质资源的保存及人工驯化栽培提供一定的理论依据。
1材料与方法
1.1试验材料
张家口市宣化区常峪口村的野生红花绶草植株。
1.2试验方法
1.2.1试验处理。本试验设置3个栽培基质处理,处理1:草炭土∶蛭石=3∶1;处理2:草炭土∶园土∶蛭石∶饼肥=2∶2∶1∶1(饼肥土);处理3:100%根原土。以上的比值均为体积比,盆栽种植,完全随机设置,每个处理5盆,重复3次,共计45盆,试验采用总体取样的方法,测定45盆全部样本。
1.2.2栽培基质物理性状的测定。栽培基质的密度使用环刀法进行测定[17];不同基质的pH值采用电位法测定[20];测量容重及孔隙度则是选择一个已知体积(V)的塑料烧杯,测量烧杯净重(W1),在烧杯中加满自然风干的待测栽培基质,称重(W2);将烧杯中的基质用已知质量的湿纱布封口,在水中浸泡24h后,从水中取出,让烧杯中的水分自由溢出,在饱和水状态下称重(W3),并按下列公式计算相应的物理指标[18]:
1.2.3绶草的植物学性状观测。绶草移栽工作于2023年4月20日开始,移栽后密切观察植株的生长状态,7-8月为绶草的各个花期,8月中下旬为结果期,9月中上旬为休眠期;在观察各生长发育进程时,每隔2d清点记录1次,以每个处理总植株50%出现该性状定为该时期的出现;株高是根茎部到植株最高点,花茎伸出前采用电子游标卡尺测量株高,花茎伸出后采用卷尺测量株高,于4月20日移栽后开始第1次测量,之后每隔15d测量1次株高;花茎自6月20日伸出后,每隔5d测量1次花茎长度;花量自7月1日出现第1个花蕾后,每隔5d记录1次,直至花蕾全部开放。
1.2.4绶草根际真菌的分离、鉴定。真菌分离:将采集的绶草周边的原土带回实验室后先阴干,阴干后用300目的土筛进行过筛,过筛后取5g用无菌水溶解,充分摇匀后,再用无菌水稀释1000倍的悬浮液,后将悬浮液0.2mL涂匀于PDA培养基上,重复3次,放置于无菌培养箱中,温度设置为25~28℃进行培养,培养形成菌落后进行分离和鉴定。真菌的鉴定采用真菌玻片培养法进行。
1.2.5移栽后管理。绶草自野外移栽后采用盆栽,45盆样本均放置于同一生长环境下且管理方式无差异。移栽初期适当遮阴,透光率不高于60%。缓苗成活后,放置于自然环境下。绶草移栽初期,基质湿度保持在70%左右,后期每隔3~5d浇1次透水。移栽后的绶草尽量避免强光直射,每隔10d喷1次液体肥,开花前以氮、磷、钾肥为主,现蕾后以钾肥为主,适当加一些硼和锌元素。同时,整个生育期及时清除杂草[20-21]。
2结果与分析
2.1不同栽培基质的物理性状比较
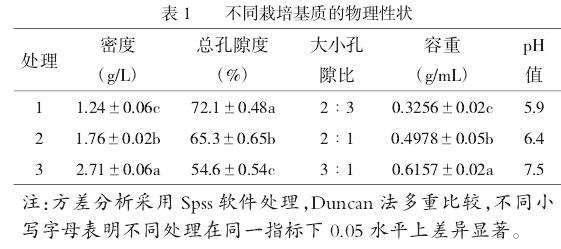

由表1可知,基质密度:处理3>处理2>处理1,3个处理间差异显著(P≤0.05)。总孔隙度,处理1、处理2、处理3分别为72.1%、65.3%和54.6%,处理1显著高于其他2个处理(P≤0.05),处理2居中,处理3最小。通气孔隙与持水孔隙的比值,处理1为2∶3,处理2为2∶1,处理3为3∶1。基质容重与密度一致,为处理3>处理2>处理1,3个处理间差异显著(P≤0.05)。测得的pH值结果显示,处理1和处理2分别为5.9、6.4,偏酸性,处理3为7.5,微碱性。
以上结果表明,处理1的通气性和持水能力要高于处理2和处理3,处理3的密度和容重大,通气性较差。处理1和处理2的栽培基质偏酸,更适宜大部分植被的生长发育。
2.2不同栽培基质对绶草植物学性状的影响
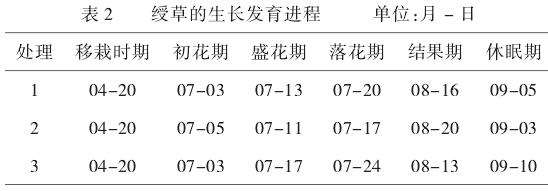

2.2.1不同栽培基质对绶草生长发育进程的影响。由表2可知,3种处理均在4月20日进行移栽,处理1的绶草植株初花期出现在7月3日,落花期为7月20日,花期持续17d,
结果期为8月16日,在9月5日进入休眠期,该处理的植株初花期相对较早,但花期持续时间较短,结果期也相对较早。处理2的植株初花期是在7月5日,落花期为7月17日,花期仅持续12d,8月20日开始结果,9月3日进入休眠期。与处理1相比,处理2的植株初花期稍晚,花期持续时间更短,结果期最晚,因此处理2的植株生育期最短。处理3的绶草植株初花期与处理1相同,落花期为7月24日,花期持续21d,进入结果期的时间最早为8月13日,进入休眠期时间最晚为9月10日,与前2种处理相比,处理3的植株生育期相对较长。综上所述,不同处理对绶草植株的生育期具有显著影响。处理3以根原土为栽培基质的植株生育期最长,处理1以草炭土∶蛭石=3∶1为栽培基质的次之,处理2以饼肥土为栽培基质的植株生育期最短。
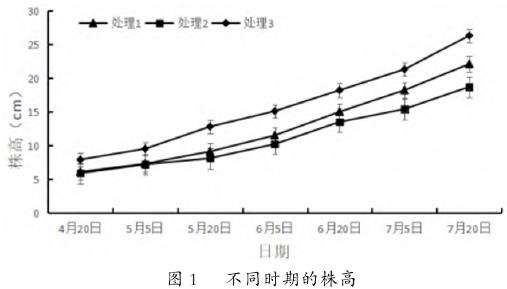
2.2.2不同栽培基质对绶草株高的影响。由图1可知,绶草的株高随着生育进程的发展逐渐增加,具体表现为,自4月20日-7月20日,处理1的株高从6.1cm增长到20.3cm,增长了233%,处理2从5.9cm增长到18.7cm,增长了217%,处理3从7.7cm增长到26.3cm,增长了242%,处理3在不同时间的测量值都高于处理1和处理2且植株生长速度最快,处理1次之,处理2植株最矮、生长速度最慢。
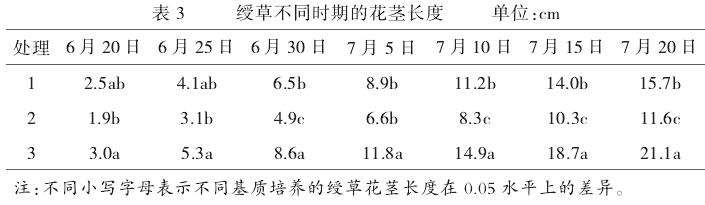

2.2.3不同栽培基质对绶草花茎长度的影响。由表3可知,绶草植株在整个生育期内的花茎长度:处理3>处理1>处理2,处理3花茎最长,并与其他2种处理之间存在显著性差异(P≤0.05)。绶草生长初期,处理1的花茎长度与处理2的花茎长度差异不显著(P≤0.05),但自7月10日起,3种处理间都存在显著差异(P≤0.05)。表明处理2的花茎生长速度较慢,处理3的生长速度较快,处理1居中。因此,栽培基质对绶草植株的花茎长度及长势具有显著影响,处理3效果最佳,处理1次之,处理2较差。
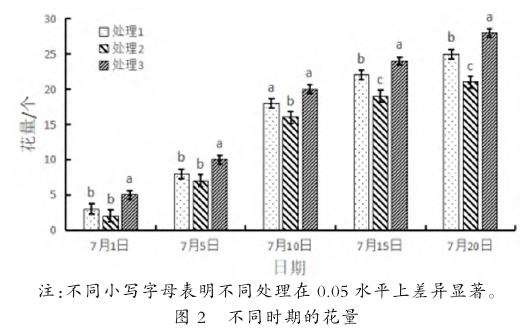
2.2.4不同栽培基质对绶草花量的影响。由图2可知,随着绶草的生长发育,3种栽培基质的花量均逐渐增加,7月1日和7月5日处理3与处理1、处理2差异显著(P≤0.05),处理1与处理2差异不显著(P≤0.05);7月10日处理1、处理3差异不显著性(P≤0.05),但两者与处理2均差异显著(P≤0.05);7月15日与7月20日3种处理均存在显著性差异(P≤0.05)。综上可知,处理3以根原土为栽培基质效果最佳。
2.3不同栽培基质环境下绶草根际真菌分布
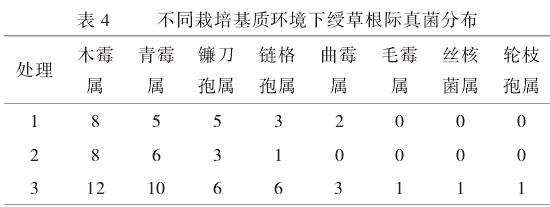

由表4可知,处理1、处理2、处理3分离后获得菌株分别为23株、18株、40株。其中主要的真菌亚门为半知菌亚门和接合菌亚门,以半知菌亚门为主。处理3分离鉴定的主要有木霉属、青霉属、镰刀孢属等8个属,其中木霉属和青霉属所占比例最大,分别是12株、10株,占总株数的30%和25%。毛霉属、丝核菌属、轮枝孢属各发现1株,数量相对较少。处理1未见毛霉属、丝核菌属、轮枝孢属,其余5个属相较于处理3也分别少4、5、1、3、1株。处理2未见曲霉属、毛霉属、丝核菌属、轮枝孢属,其余4个属相较于处理3分别少4、4、3、5株。
3结论与讨论
本试验对不同混合基质的物理性状进行测定,处理3的密度、容重大于处理1、处理2,通气和持水能力弱于其他2种基质处理,且酸碱度偏碱,处理1、处理2的栽培基质物理性状更适合绶草植株的生长发育,但试验结果表明,处理3的绶草株高、花茎长度及花量等生长指标优于处理1和处理2。
这个结果与根际真菌分布有关,真菌在兰科种子的萌发过程中发挥着至关重要的作用,在后期的生长发育中也需要真菌提供营养物质如氮、磷等,并且与真菌共生能够增强兰科植物的抗胁迫性,提高植株成活率[22-23]。丰富的根际真菌可以影响土壤微生物群落结构的稳定性[24],不仅可以防御外来微生物的入侵,保证植株不受病害的侵害。同时真菌能够分解复杂的有机物质,释放出植物可以利用的养分,促进绶草的生长发育[25-26]。
处理3为根原土,其含有更多适宜绶草发育的真菌种类和数量,本研究结果也表明了这点。因此,处理3的绶草植株生长发育状况较好,这与前人的研究一致[4,27]。处理1和处理2原基质中不含有真菌,栽培绶草一段时间后,其栽培基质中分别分解出5种和4种真菌,这可能是与绶草植株的内生真菌影响了栽培基质的微生物群落[28]有关。
人工驯化栽培野生绶草是种质资源保护和资源有效利用的最佳途径之一,栽培基质的选用和混合配比非常关键。本研究采用草炭土、蛭石、饼肥土等基质栽培野生绶草,经过一段时间的驯化后,绶草的生物学性状均表现良好,未出现停长或死亡现象。目前,以绶草花茎、肉质根、幼叶、腋芽、种子等作为外植体的组织培养人工繁育技术也取得了很大进展[15-16,29]。随着绶草繁殖技术和栽培技术的不断完善,绶草更能发挥其药用价值和观赏价值。
综上所述,野生绶草的人工驯化工作是可行的,3种栽培基质都可以使绶草植株正常生长,本研究结果为野生绶草的人工驯化提供了理论基础[21]。

