紫金四季草莓组怎么培快繁技术研究
2023-11-28
黄雅茹4
核心提示:草莓分为季节草莓和四季草莓2种类型。季节草莓春冬季结果,占全国种植面积97%以上,而四季草莓能四季结果,可填补夏秋季草莓鲜果空白。市场上主栽的四季草莓为欧美品种‘蒙特瑞’,但该品种果实偏酸,且仅在夏季冷凉地区开花结果,
紫金四季草莓组培快繁技术研究
黄雅茹1,2,郭雨亭2,3,牛歆雨3,赵密珍2,王静2*(1南京农业大学园艺学院,江苏南京210095,2江苏省农业科学院果树研究所/江苏省高效园艺作物遗传改良重点试验室,江苏南京2100144,3西藏农牧学院植物科学学院,西藏林芝860000)
摘要:以‘紫金四季’草莓为试材,其匍匐茎茎尖为外植体,进行诱导培养、伸长培养、增殖培养、培养条件的筛选研究。结果表明,组培快繁技术中,先采用暗培养14d后转入光培养,萌芽率更高,诱导培养基以6-BA3.4mg/L+IBA0.3mg/L为最佳,萌芽率为52.77%;伸长培养基以6-BA1.7mg/L+IBA0.15mg/L为最佳,生长速度中等,生长状态最佳;增殖培养基以6-BA0.75mg/L为最佳,综合来说,诱导生芽后经伸长培养再增殖培养效果最优。
草莓是蔷薇科草莓属的多年生草本植物[1],因周期短、见效快、效益高,成为多地设施农业的首选产业[2-3]。截至2020年,我国草莓的种植面积达126644hm2,种植面积和产量均居世界第一[4]。
草莓分为季节草莓和四季草莓2种类型。季节草莓春冬季结果,占全国种植面积97%以上,而四季草莓能四季结果,可填补夏秋季草莓鲜果空白。市场上主栽的四季草莓为欧美品种‘蒙特瑞’,但该品种果实偏酸,且仅在夏季冷凉地区开花结果,在江浙等夏季高温地区七八月不能开花[5]。江苏省农科院根据当地气候条件选育出‘紫金四季’,酸甜适口,可供江浙沪皖等夏季高温地区夏秋栽培生产[6],其卡脖子问题在于匍匐茎发生的能力较弱,种苗、子苗发生数量少[7]。尽管目前已有关于‘紫金四季’组培技术的研究,但其采用‘紫金四季’脱毒苗的叶片及叶柄为外植体[7],通过叶片诱导愈伤组织产生不定芽,在实际生产中并不能直接获取‘紫金四季’脱毒苗,且通过愈伤组织阶段所需时间长,并容易产生变异;同时该培养过程采用多种激素处理,增加了配制时间和操作难度。
本试验以‘紫金四季’草莓匍匐茎尖为外植体,进行诱导培养组配、伸长培养、增殖培养及培养条件等试验,总结出一套合适的组培配方和流程,提高了组培效率,为‘紫金四季’大面积推广生产提供技术支撑。
1材料与方法
1.1试材及取样
以江苏省农科院园艺研究所提供的草莓品种‘紫金四季’为试材。于6-10月选择种植在栽培介质(土、基质等)未发生病虫害、植株长势强、营养生长期100d以上、根颈部直径1cm以上、叶片颜色深绿色的植株,
剥开匍匐茎顶端叶片,选取匍匐茎茎尖为外植体展开试验。
1.2外植体处理
将采集的匍匐茎在碱性洗涤剂中浸泡20~40min、自来水冲洗5~6次后,用流水继续冲洗30~60min,再用蒸馏水冲洗2~3次,冲洗干净后转至超净工作台。在超净工作台上,将匍匐茎用75%乙醇浸泡15s、无菌水冲洗4~6次,再用0.8%次氯酸钠溶液消毒浸泡15min,无菌水冲洗4~6次,无菌滤纸吸干;置于无菌培养皿中,在显微镜下用无菌刀片取匍匐茎茎尖生长点0.2~0.8mm。
1.3试验方法
1.3.1培养条件。培养室内温度为24±2℃。暗培养,无光照;光培养,培养瓶上部的光照强度为100~200μmol/m2·s,每日光照12~16h。
1.3.2诱导培养。‘紫金四季’外植体以诱导培养基(MS固体培养基、6-BA、IBA、蔗糖3%、琼脂6~7g/L)为基础,以6-BA(3.4mg/L、1.7mg/L、0.5mg/L)、IBA(0mg/L、0.3mg/L)不同浓度相互组合,对照组为6-BA0.5mg/L,光培养下生长;在确定最优诱导培养基后,再确定培养条件,处理1为经14d暗培养后再转入光培养;处理2为直接光培养;28d继代1次,第40d统计生芽数。
1.3.3伸长培养。当不定芽长至0.3~0.5cm,转置于伸长培养基(MS固体培养基、6-BA、IBA、蔗糖3%、琼脂6~7g/L)中光培养,以6-BA(1.7mg/L、0.75mg/L)、IBA(0.15mg/L、0mg/L)两两组合共4组,对照组为6-BA0.5mg/L,光培养下生长,得到单芽或丛生芽丛,将芽丛切割成单芽,若单芽<1cm,在伸长培养基中继代,21~28d继代1次。
1.3.4增殖培养。待单芽长至1~3cm,转至增殖培养基(MS固体培养基、6-BA、IBA、蔗糖3%、琼脂6~7g/L)光培养,设6-BA1.7mg/L、0.75mg/L,对照组为6-BA0.5mg/L。得到芽丛,将芽丛切割单芽,若单芽<3cm,继续在增殖培养基中继代培养,21~28d继代培养1次。1.3.5生根培养。待单芽长至3~5cm,取生长健壮、至少有3小叶的单芽移入生根培养基(1/2MS固体培养基+IBA0.003mg/L+葡萄糖1.0%+琼脂6~7g/L),暗培养7d后转入光培养7~21d,至根长1.5~3cm且长出2条以上幼根时开始炼苗移栽。
1.4数据分析
以LSD法进行多重比较并检测差异显著性,以P<0.05为差异显著水平;不同光培养为t-test检验。
2结果与分析
2.1不同激素不同培养条件对外植体分化的影响
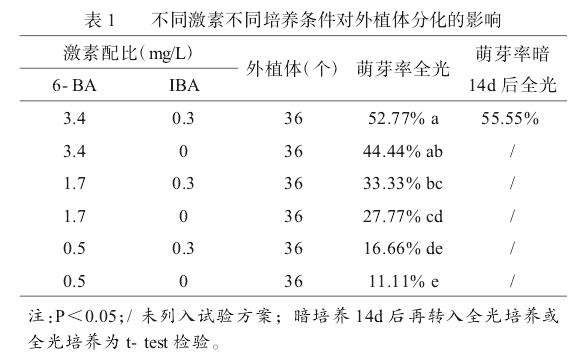
‘紫金四季’出芽较慢,28d时,高浓度激素配比出现部分丛芽,6-BA为0.5mg/L处理的则无芽点出现,其余处理均有少量芽出现;40d时,各激素配比萌芽率如表1所示,当6-BA浓度为0.5、1.7、3.4mg/L时,萌芽率分别为11.11%、27.77%、44.44%,表明高浓度的6-BA可以显著提高萌芽率;在3组对比中,添加IBA比没有添加IBA的萌芽率分别提高了5.55%、5.56%、8.33%,这表明添加IBA可以促进芽的发生;暗培养14d后全光培养可提高出芽数,但无显著差异。因此最有效的诱导培养基为:MS固体培养基+6-BA3.4mg/L+IBA0.3mg/L+蔗糖3%+琼脂6~7g/L,先暗培养14d后再转入光培养。
2.2不同激素对外植体生长与增殖的影响
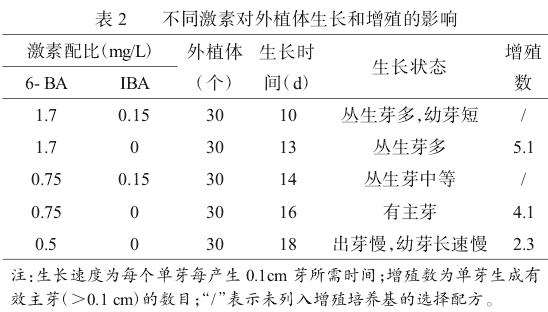

高浓度6-BA易分化,芽多、芽密、呈丛状,因此要使芽伸长,保证出芽的同时又要促进主芽生长。当不定芽长至0.3~0.5cm后,转置于伸长培养基光培养,在伸长培养中,如表2所示,随着6-BA浓度的提高,增殖数随之增加,生长速度也随之提高,其中6-BA1.7mg/L+IBA0.15mg/L这一配比提高了生长速度,但丛生芽多、幼芽短,当6-BA浓度在0.75mg/L时,既兼顾出芽又兼顾伸长壮苗增殖。
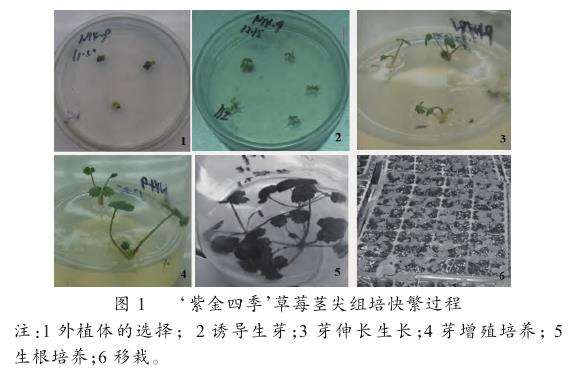

综合萌芽率、伸长速度、增殖数考虑,组培快繁技术中,采用先暗培养再光培养,不断降低培养基中6-BA、IBA浓度(诱导培养基:6-BA3.4mg/L+IBA0.3mg/L;伸长培养基:6-BA1.7mg/L+IBA0.15mg/L;增殖培养基:6-BA0.75mg/L),诱导生芽后经伸长培养再增殖培养的培养方案,所有过程如图1所示。
3讨论
本试验以‘紫金四季’为试材,研究了其茎尖组培快繁技术。由于季节草莓‘宁玉’在光培养下MS+0.5mg/L6-BA+NAA0.1mg/L培养基中可诱导生芽[8],而‘紫金四季’在同等条件下难生芽。因此以‘紫金四季’为外植体,将NAA改换为IBA,提高6-BA、IBA浓度,通过排列组合配比方式确定最优培养基,之后再检测光、暗培养对生芽的影响。
诱导培养试验结果表明,高浓度的6-BA和IBA的添加能显著提高萌芽率,这与黄登艳等[9]以隋珠为试材的诱导培养基试验和吴海红等[10]以矾根品种‘草莓漩涡’为试材的丛生芽诱导试验的结果一致。植物激素和植物生长调节剂的种类和比例对茎尖的萌发和分化起着重要作用,6-BA属于细胞分裂素类,具有促进细胞分裂,诱导萌发新芽以及愈伤组织的形成,IBA属于生长素类,促进植物主根生长,提高植物发芽率和成活率。
本试验在添加IBA的对比中可以看出,IBA的添加显著提高了新芽的萌发和伸长,这与李会珍等[11]以红颊为试材的试验结果一致,韩如春等[12]在以‘红颜’和‘隋珠’茎尖为外植体的试验中发现,诱导培养基中6-BA的浓度设置为0、0.1、0.3、0.5、1.0mg/L时,成活率和诱导率起初随着浓度的提高而增加,但成活率在浓度为0.5mg/L时达到最大值,随后降低,而诱芽率在浓度为0.3mg/L时达到最大值,随后降低,而且过高的浓度会出现畸形苗、褐化严重、玻璃化显著[13]等问题,支持细胞分裂素的浓度过高使组培苗变异频率增加[14-15]的结论,这表明成活率和诱导率并不是随着6-BA浓度的提高而增加,存在最适宜浓度。本试验在前期预试验中发现,超过3.5mg/L6-BA易产生丛生芽和玻璃化现象,因此选择3.4mg/L6-BA。
本试验设置IBA激素浓度较低,可能较高或较低浓度的IBA水平效果更优,但考虑到诱导培养主要目标为出芽,0.3mg/LIBA与高浓度6-BA已起到作用,因此并未设置更细致的激素水平。暗培养后转入光培养可提高出芽率,但是与全光对照效果不显著;在天数设置上,充分考虑了出芽的速度和出芽后芽的生长状态,仅设置了14d,或许存在更适宜的暗培养天数可显著提高出芽率,前人[16-17]的研究表明,对‘红颜’草莓茎尖暗处理3d和5d能够提高萌发率1倍以上,对‘白雪公主’草莓茎尖暗处理3d可有效加快萌发。
本试验在添加IBA的对比中可以看出,IBA的添加显著提高了新芽的萌发和伸长,这与李会珍等[11]以红颊为试材的试验结果一致,韩如春等[12]在以‘红颜’和‘隋珠’茎尖为外植体的试验中发现,诱导培养基中6-BA的浓度设置为0、0.1、0.3、0.5、1.0mg/L时,成活率和诱导率起初随着浓度的提高而增加,但成活率在浓度为0.5mg/L时达到最大值,随后降低,而诱芽率在浓度为0.3mg/L时达到最大值,随后降低,而且过高的浓度会出现畸形苗、褐化严重、玻璃化显著[13]等问题,支持细胞分裂素的浓度过高使组培苗变异频率增加[14-15]的结论,这表明成活率和诱导率并不是随着6-BA浓度的提高而增加,存在最适宜浓度。本试验在前期预试验中发现,超过3.5mg/L6-BA易产生丛生芽和玻璃化现象,因此选择3.4mg/L6-BA。
本试验设置IBA激素浓度较低,可能较高或较低浓度的IBA水平效果更优,但考虑到诱导培养主要目标为出芽,0.3mg/LIBA与高浓度6-BA已起到作用,因此并未设置更细致的激素水平。暗培养后转入光培养可提高出芽率,但是与全光对照效果不显著;在天数设置上,充分考虑了出芽的速度和出芽后芽的生长状态,仅设置了14d,或许存在更适宜的暗培养天数可显著提高出芽率,前人[16-17]的研究表明,对‘红颜’草莓茎尖暗处理3d和5d能够提高萌发率1倍以上,对‘白雪公主’草莓茎尖暗处理3d可有效加快萌发。
伸长培养及增殖培养试验结果表明,随6-BA浓度的增加,其生长速度不断缩短,出芽越快,增殖数显著增加,但6-BA浓度越高,丛生芽较多;当6-BA浓度为0.5mg/L时,增殖慢,出芽慢,幼芽长速慢,这与王亚妮等[18]研究结果一致;为保证主芽生长,试验采用不断降低6-BA浓度的方法,与不添加IBA的培养基相比,添加IBA的表现更好。
综合诱导分化率、生长速度及增殖系数,‘紫金四季’草莓以匍匐茎为外植体,先暗培养14d再转入光培养;诱导培养基:MS固体培养基+6-A3.4mg/L+IBA0.3mg/L+蔗糖3%+琼脂6~7g/L;伸长培养基:MS固体培养基+6-BA1.7mg/L+IBA0.15mg/L+蔗糖3%+琼脂6~7g/L;增殖培养基:MS固体培养基+6-BA0.75mg/L+蔗糖3%+琼脂6~7g/L;生根培养基:1/2MS固体培养基+IBA0.003mg/L+葡萄糖1.0%+琼脂6~7g/L。
综合诱导分化率、生长速度及增殖系数,‘紫金四季’草莓以匍匐茎为外植体,先暗培养14d再转入光培养;诱导培养基:MS固体培养基+6-A3.4mg/L+IBA0.3mg/L+蔗糖3%+琼脂6~7g/L;伸长培养基:MS固体培养基+6-BA1.7mg/L+IBA0.15mg/L+蔗糖3%+琼脂6~7g/L;增殖培养基:MS固体培养基+6-BA0.75mg/L+蔗糖3%+琼脂6~7g/L;生根培养基:1/2MS固体培养基+IBA0.003mg/L+葡萄糖1.0%+琼脂6~7g/L。
